Phương pháp nhận biết các chất cô vơ
I2 Hồ tinh bột Màu xanh tím
N2 Que diêm cháy đỏ Que diêm tắt
NH3 Quỳ tím ẩm Hóa xanh
Khí HCl Tạo khối trắng NH3 + HCl → NH4Cl
Bạn đang xem tài liệu "Phương pháp nhận biết các chất cô vơ", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
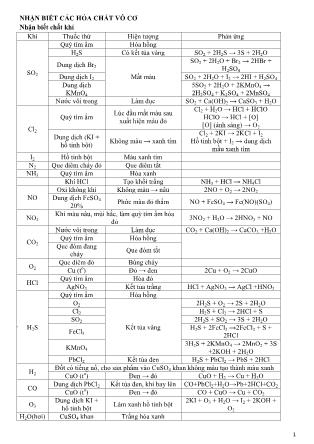
1 NHẬN BIẾT CÁC HÓA CHẤT VÔ CƠ Nhận biết chất khí Khí Thuốc thử Hiện tượng Phản ứng SO2 Quỳ tím ẩm Hóa hồng H2S Có kết tủa vàng SO2 + 2H2S → 3S + 2H2O Dung dịch Br2 Mất màu SO2 + 2H2O + Br2 → 2HBr + H2SO4 Dung dịch I2 SO2 + 2H2O + I2 → 2HI + H2SO4 Dung dịch KMnO4 5SO2 + 2H2O + 2KMnO4 → 2H2SO4 + K2SO4 + 2MnSO4 Nước vôi trong Làm đục SO2 + Ca(OH)2 → CaSO3 + H2O Cl2 Quỳ tím ẩm Lúc đầu mất màu sau xuất hiện màu đỏ Cl2 + H2O → HCl + HClO HClO → HCl + [O] [O] (ánh sáng) → O2 Dung dịch (KI + hồ tinh bột) Không màu → xanh tím Cl2 + 2KI → 2KCl + I2 Hồ tinh bột + I2 → dung dịch mầu xanh tím I2 Hồ tinh bột Màu xanh tím N2 Que diêm cháy đỏ Que diêm tắt NH3 Quỳ tím ẩm Hóa xanh Khí HCl Tạo khối trắng NH3 + HCl → NH4Cl NO Oxi không khí Không màu → nâu 2NO + O2 → 2NO2 Dung dịch FeSO4 20% Phức màu đỏ thẩm NO + FeSO4 → Fe(NO)(SO4) NO2 Khí màu nâu, mùi hắc, làm quỳ tím ẩm hóa đỏ 3NO2 + H2O → 2HNO3 + NO CO2 Nước vôi trong Làm đục CO2 + Ca(OH)2 → CaCO3 +H2O Quỳ tím ẩm Hóa hồng Que đóm đang cháy Que đóm tắt O2 Que diêm đỏ Bùng cháy Cu (t o ) Đỏ → đen 2Cu + O2 → 2CuO HCl Quỳ tím ẩm Hóa đỏ AgNO3 Kết tủa trắng HCl + AgNO3 → AgCl +HNO3 H2S Quỳ tím ẩm Hóa hồng O2 Kết tủa vàng 2H2S + O2 → 2S + 2H2O Cl2 H2S + Cl2 → 2HCl + S SO2 2H2S + SO2 → 3S + 2H2O FeCl3 H2S + 2FeCl3 →2FeCl2 + S + 2HCl KMnO4 3H2S + 2KMnO4 → 2MnO2 + 3S +2KOH + 2H2O PbCl2 Kết tủa đen H2S + PbCl2 → PbS + 2HCl H2 Đốt có tiếng nổ, cho sản phẩm vào CuSO4 khan không màu tạo thành màu xanh CuO (t o ) Đen → đỏ CuO + H2 → Cu + H2O CO Dung dịch PbCl2 Kết tủa đen, khí bay lên CO+PbCl2+H2O→Pb+2HCl+CO2 CuO (t o ) Đen → đỏ CO + CuO → Cu + CO2 O3 Dung dịch KI + hồ tinh bột Làm xanh hồ tinh bột 2KI + O3 + H2O → I2 + 2KOH + O2 H2O(hơi) CuSO4 khan Trắng hóa xanh 2 Nhận biết ion dương Ion Thuốc thử Hiện tượng Phản ứng Li + Đốt trên ngọn lửa đèn khí không màu Ngọn lửa màu đỏ thẩm Na + Ngọn lửa màu vàng tươi K + Ngọn lửa màu tím Ca 2+ Ngọn lửa màu đỏ da cam Ba 2+ Ngọn lửa màu lục Ca 2+ Dung dịch SO4 2- , CO3 2- Kết tủa trắng Ca 2+ + SO4 2- → CaSO4 Ca 2+ + CO3 2- → CaCO3 Ba 2+ Kết tủa trắng Ba 2+ + SO4 2- → BaSO4 Ba 2+ + CO3 2- → BaCO3 Ag + HCl, HBr, HI, NaCl, NaBr, NaI AgCl kết tủa trắng AgBr kết tủa vàng nhạt AgI kết tủa vàng đậm Ag + + Cl - → AgCl Ag + + Br - → AgBr Ag + + I - → AgI Pb 2+ Dung dịch KI Kết tủa vàng Pb2+ + 2I- → PbI2 Hg 2+ Kết tủa đỏ Hg2+ + 2I- → HgI2 Pb 2+ Na2S, H2S Kết tủa đen Pb2+ + S2- → PbS Hg 2+ Kết tủa đỏ Hg2+ + S2- → HgS Fe 2+ Kết tủa đen Fe2+ + S2- → FeS Cu 2+ Kết tủa đen Cu2+ + S2- → CuS Cd 2+ Kết tủa vàng Cd2+ + S2- → CdS Ni 2+ Kết tủa đen Ni2+ + S2- → NiS Mn 2+ Kết tủa hồng nhạt Mn2+ + S2- → MnS Zn 2+ Dung dịch NH3 Kết tủa trắng, sau đó tan Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2 Cu 2+ Kết tủa xanh, sau đó tan tạo dung dịch xanh thẩm Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 Ag 2+ Kết tủa trắng, sau đó tan AgOH + 2NH3 → [Ag(NH3)2](OH) Mg 2+ Dung dịch kiềm Kết tủa trắng Mg2+ + 2OH- → Mg(OH)2 Fe 2+ Kết tủa trắng xanh hóa nâu ngoài không khí Fe 2+ + 2OH - → Fe(OH)2 Fe 3+ Kết tủa nâu đỏ Fe3++ 3OH- → Fe(OH)3 Al 3+ Kết tủa keo trắng tan trong kiềm dư Al 3+ + 3OH - → Al(OH)3 Al(OH)3 + OH - → AlO2 - + H2O Zn 2+ Kết tủa trắng tan trong kiềm dư Zn 2+ + 2OH - → Zn(OH)2 Zn(OH)2 +2OH -→ZnO2 2- +2H2O Be 2+ Be 2+ + 2OH - → Be(OH)2 Be(OH)2+2OH - →BeO2 2- + 2H2O Pb 2+ Pb 2+ + 2OH - → Pb(OH)2 Pb(OH)2+2OH - →PbO2 2- +2H2O Cr 3+ Kết tủa xanh lục, tan trong kiềm dư Cr 3+ + 3OH - → Cr(OH)3 Cr(OH)3 + OH - → CrO2 - + H2O Cu 2+ Kết tủa xanh lam Cu2++ 2OH- → Cu(OH)2 NH4 + Khí NH3 có mùi khai NH4 + + OH - → NH3 + H2O 3 Nhận biết ion âm Ion Thuốc thử Hiện tượng Phản ứng OH - Quỳ tím Phenol Hóa xanh Hóa hồng Cl - AgNO3 Kết tủa trắng Cl- + Ag+ → AgCl Br - Kết tủa vàng nhạt Br- + Ag+ → AgBr PO4 3- Kết tủa vàng PO4 3- + 3Ag + → Ag3PO4 S 2- Kết tủa đen S2- + 2Ag+ → Ag2S I - Kết tủa vàng đậm I- + Ag+ → AgI CO3 2- BaCl2 Kết tủa trắng CO3 2- + Ba 2+ → BaCO3 (tan trong HCl) SO3 2- Kết tủa trắng SO3 2- + Ba 2+ → BaSO3 (tan trong HCl) SO4 2- Kết tủa trắng SO4 2- + Ba 2+ → BaSO4 (không tan trong HCl) CrO4 2- Kết tủa vàng CrO4 2- + Ba 2+ → BaCrO4 S 2- Pb(NO3)2 Kết tủa đen S 2- + Pb 2+ → PbS CO3 2- HCl Sủi bọt khí CO3 2- + 2H + → CO2 + H2O SO3 2- Sủi bọt khí mùi hắc SO3 2- + 2H + → SO2 + H2O S 2- Sủi bọt khí mùi trứng thối S 2- + 2H + → H2S SiO3 2- Kết tủa keo SiO3 2- + 2H + → H2SiO3 HCO3 - Đun nóng Sủi bọt khí 2HCO3 - → CO2 + CO3 2- + H2O HSO3 - Sủi bọt khí 2HSO3 - → SO2 + SO3 2- + H2O NO3 - Vụn Cu và dd H2SO4 Khí không màu hóa nâu ngoài không khí 3Cu + 8H + + 2NO3 - → 3Cu2+ + 2NO + 4H2O NO2 - H2SO4 Khí không màu hóa nâu ngoài không khí NO2 - + H + → HNO2 3HNO2 → 2NO + HNO3 + H2O 2NO + O2 → 2NO2 Nhận biết các oxit kim loại Hỗn hợp oxit: hòa tan từng oxit vào nước (2 nhóm: tan và không tan). Nhóm tan trong nước cho tác dụng với CO2. Nếu không có kết tủa: kim loại trong oxit là kim loại kiềm (nhóm IA). Nếu có kết tủa: kim loại trong oxit là kim loại kiềm thổ (nhóm IIA). Nhóm không tan trong nước tác dụng với dd kiềm: Nếu oxit tan trong kiềm: kim loại trong oxit là Be, Al, Zn, Cr, Pb, Nếu oxit tan trong kiềm: kim loại trong oxit là các kim loại còn lại (Cu, Ni, ). Nhận biết một số oxit (Na2O, K2O, CaO, BaO) cho tác dụng với nước, dung dịch làm quỳ tím hóa xanh. ZnO, Al2O3 vừa tác dụng với dung dịch axit vừa tác dụng với dung dịch bazơ. CuO tác dụng với dung dịch axit tạo dung dịch có màu xanh. P2O5 cho tác dụng với nước → làm quỳ tím hóa đỏ. MnO2 cho tác dụng với dung dịch HCl đặc có khí Cl2 màu vàng nhạt xuất hiện. SiO2 không tan trong nước nhưng tan trong dung dịch NaOH đặc hoặc dung dịch HF.
Tài liệu đính kèm:
 phuong_phap_nhan_biet_cac_chat_co_vo.pdf
phuong_phap_nhan_biet_cac_chat_co_vo.pdf



