Tổng hợp lý thuyết môn Hóa học 12
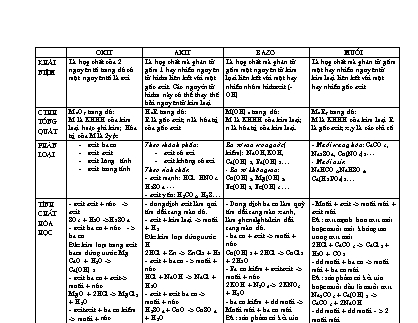
Khái niệm Là hợp chất của 2 nguyên tố trong đó có một nguyên tố là oxi Là hợp chất mà phân tử gồm 1 hay nhiều nguyên tử hidro liên két với một gốc axit. Các nguyờn tử hidro này có thể thay thế bởi nguyên tử kim loại Là hợp chất mà phân tử gồm một nguyên tử kim lọai liên kết với một hay nhiều nhóm hidroxit (-OH) Là hợp chất mà phân tử gồm một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit
Bạn đang xem tài liệu "Tổng hợp lý thuyết môn Hóa học 12", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
oxit axit Bazơ Muối Khái niệm Là hợp chất của 2 nguyên tố trong đó có một nguyên tố là oxi Là hợp chất mà phân tử gồm 1 hay nhiều nguyên tử hidro liên két với một gốc axit. Các nguyờn tử hidro này có thể thay thế bởi nguyên tử kim loại Là hợp chất mà phân tử gồm một nguyên tử kim lọai liên kết với một hay nhiều nhóm hidroxit (-OH) Là hợp chất mà phân tử gồm một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit CTHH tổng quát MxOy trong đó: M là KHHH của kim loại hoặc phi kim; Hóa trị của M là 2y/x HnR trong đó: R là gốc axit; n là hóa trị của gốc axit M(OH)n trong đó: M là KHHH của kim loại; n là hóa trị của kim loại. MxRy trong đó: M là KHHH của kim loại R là gốc axit; x,y là các chỉ số Phân loại oxit ba zơ oxit axit oxit lưỡng tính oxit trung tính Theo thành phần: axit có oxi axit không có oxi Theo tính chất: - axit mạnh: HCl. HNO3. H2SO4 - axit yếu: H2CO3, H2S Ba zơ tan trong nước( kiềm): NaOH,KOH, Ca(OH)2, Ba(OH)2 - Ba zơ không tan: Cu(OH)2, Mg(OH)2, Fe(OH)2, Fe(OH)3 - Muối trung hòa: CaCO3, Na2SO4, Cu(NO3)2 - Muối axit: NaHCO3,NaHSO4, Ca(H2PO4)2 Tính chất Hóa học - oxit axit + nước -> axit SO3 + H2O ->H2SO4 - oxit ba zơ + nước - > ba zơ Đk: kim loại trong oxit bazo đứng trước Mg CaO + H2O -> Ca(OH)2 - oxit ba zơ + axit-> muối + nước MgO + 2HCl -> MgCl2 + H2O - oxitaxit + ba zơ kiềm -> muối + nước CO2 + 2NaOH -> Na2CO3 + H2O - oxitaxit + oxitba zơ -> muối CO2 + CaO -> CaCO3 -oxit bazo + kim loại mạnh hơn -> oxit bazo mới + kim loại mới 2Al + Fe2O3 -> Al2O3 + 2Fe - dung dịch axit làm quì tím đổi sang màu đỏ. - axit + kim loại -> muối + H2 Đk: kim loại đứng trước H 2HCl + Zn -> ZnCl2 + H2 - axit + ba zơ - > muối + nước HCl + NaOH -> NaCl + H2O - axit + oxit ba zơ -> muối + nước H2SO4 + CuO -> CuSO4 + H2O - axit + muối -> muối mới + axit mới Đk: axit mạnh hơn axit mới hoặc muối mới khụng tan trong axit mới H2SO4 + Na2SO3 -> Na2SO4 + H2O + SO2 - Dung dịch ba zơ làm quỳ tím đổi sang màu xanh, làm phenolphtalein đổi sang màu đỏ. - ba zơ + axit -> muối + nước Cu(OH)2 + 2HCl -> CuCl2 + 2H2O - Ba zơ kiềm + oxitaxit -> muối + nước 2KOH + N2O5 -> 2KNO3 + H2O - ba zơ kiềm + dd muối -> Muối mới + ba zơ mới Đk: sản phẩm cú kết tủa hoặc muối đầu là muối axit 2NaOH + CuSO4 -> Na2SO4 + Cu(OH)2 - Ba zơ không tan bị nhiệt phân hủy thành oxit ba zơ tương ứng + nước Mg(OH)2 -> MgO + H2O - Muối + axit -> muối mới + axit mới Đk: axit mạnh hơn axit mới hoặc muối mới khụng tan trong axit mới 2HCl + CaCO3 -> CaCl2 + H2O + CO2 - dd muối + ba zơ -> muối mới + ba zơ mới Đk: sản phẩm cú kết tủa hoặc muối đầu là muối axit Na2CO3 + Ca(OH)2 -> CaCO3 + 2NaOH - dd muối + dd muối - > 2 muối mới Đk: sản phẩm cú kết tủa Na2SO4 + BaCl2 -> 2NaCl + BaSO4 - dd muối + kim loại -> muối mới + kim loại mới. Đk: kim loại mạnh hơn kim loại mới; kim loại khụng mạnh hơn Mg CuSO4 + Zn -> ZnSO4 + Cu - nhiều muối bị phân hủy ở nhiệt độ cao. MgCO3 -> MgO + CO2 2KMnO4 -> K2MnO4 + MnO2 + O2 Điều chế 1.kim loại + oxi-> oxitba zơ 2Cu + O2 -> 2CuO 2.Phi kim + Oxi -> oxitaxit S + O2 -> SO2 3.Ba zơ không tan ->oxitba zơ + nước Cu(OH)2 -> CuO + H2O 4.Axit ---> Nước + oxitaxit (anhidrit) 5.Muối cacbonatà oxitba zơ + CO2 CaCO3---> CaO + CO2 6.Muối nitrat -> oxit + 2Cu(NO3)2 -> 2CuO + 4NO2 + O2 7.hợp chất hữu cơ + oxi -> oxit CH4 + 2O2-> CO2 + 2H2O 8.Oxi + oxit kim loại(oxit phi kim)-> oxit mới 2SO2 + O2 -> 2 SO3 4 FeO + O2 -> 2Fe2O3 2CO + O2 -> 2CO2 9.Kim loại + axit(HNO3, H2SO4) -> oxit Cu + 4 HNO3 -> Cu(NO3)2 +2NO2 + 2H2O Cu + 2H2SO4-- -> CuSO4 + 2H2O + SO2 1.Phi kim + hidro( +H2O) -> dd axit hidric H2 + Cl2 -> 2HCl 2. oxit axit + H2O -> dd axit SO3 + H2O -> H2SO4 3. axit + Muối -> muối mới + axit mới H2SO4 + BaCl2 -> BaSO4 + HCl 4. Điện phân muối: CuSO4 + 2H2O-> Cu + O2 + 2H2SO4 1.Kim loại (kiềm, kiềm thổ) + H2O-> ba zơ kiềm 2K + 2H2O -> 2KOH + H2 2. oxit ba zơ kiềm + H2O -> dd kiềm BaO + H2O -> Ba(OH)2 3. dd kiềm + dd muối -> muối mới + ba zơ mới Na2CO3 + Ca(OH)2 -> 2NaOH + CaCO3 4. điện phân dd muối: 2NaCl + 2H2O-> 2NaOH + H2 + Cl2 1.axit + ba zơ -> Muối + H2O HCl + NaOH -> NaCl + H2O 2. axit + oxit ba zơ -> muối + H2O H2SO4 + CuO -> CuSO4 + H2O 3. axit + kim loại -> muối + H2 H2SO4 + Zn -> ZnSO4 + H2 4. axit + muối -> muối mới + axit mới CuCl2 + H2S -> CuS + 2HCl 5.Ba zơ kiềm+ dd muối -> muối mới + ba zơ mới. 2KOH + CuCl2 -> 2KCl + Cu(OH)2 6. Ba zơ kiềm + oxit axit -> muối + H2O 2NaOH +N2O5 -> 2NaNO3 + H2O 7. Ba zơ kiềm + oxit lưỡng tính -> muối + nước 2NaOH + Al2O3 -> 2NaAlO2 + H2O 8. ba zơ kiềm + hidroxit lưỡng tính->Muối + nước 2KOH + Zn(OH)2 -> K2ZnO2 + 2H2O 9.dd kiềm + kim loại -> muối + H2 2NaOH + 2H2O + 2Al -> 2NaAlO2 + 3 H2 10. Ba zơ kiềm + phi kim -> muối + H2O 2NaOH + Cl2 -> NaCl + NaClO + H2O 11. Kim loại + dd muối -> muối mới + kim loại mới Cu + 2AgNO3 -> Cu(NO3)2 + 2Ag 12. Kim loại + phi kim -> muối 2Fe + 3Cl2 -> 2FeCl3 13. Muối + phi km -> Muối mới + phi kim mới 2KBr + Cl2 -> 2KCl + Br2 14.Muối + muối -> 2 muối mới NaCl + AgNO3 -> NaNO3 + AgCl 15. Nhiệt phân muối : 2KNO3 -> 2KNO2 + O2 16. Phi kim + muối có tính khử: 2FeCl2 + Cl2 -> 2FeCl3 17. Kim loại + muối có tính oxi hóa: Fe + 2FeCl3 -> 3FeCl2 18. Muối axit + dd kiềm -> muối trung hòa + nước 2NaHCO3 +2 KOH -> Na2CO3 + K2CO3 + 2H2O Tớnh chất húa học của kim loại -Kim loại + axit -> muối + H2. Đk: Kl trước H. -Kim loại + phi kim -> muối. -Kim loại + oxit bazo -> kim loại mới + oxit bazo mới. Đk: kim loại mạnh hơn kl mới. -Kim loại + dd muối -> kim loại mới + muối mới. Đk: kim loại mạnh hơn kl mới nhưng k đứng trước Mg. -Kim loại + H2O -> bazo + H2. Đk: kl đứng trước Mg
Tài liệu đính kèm:
 tong_hop_ly_thuyet_mon_hoa_hoc_12.doc
tong_hop_ly_thuyet_mon_hoa_hoc_12.doc



